Wie engagiert sich J&J in klinischer Forschung?

Auf dieser Seite informieren wir Sie über unsere innovativen Prozesse zur Entwicklung neuer Medikamente. Wir erklären, wie wir neue Therapien entwickeln, welche Bedeutung klinische Studien haben und wie wir die Patientensicherheit gewährleisten. Außerdem geben wir einen Überblick über unsere verschiedenen Forschungsbereiche. Mit täglichen Investitionen von rund 20 Millionen Euro weltweit setzen wir uns dafür ein, Krankheiten von morgen zu besiegen. Besuchen Sie uns und erfahren Sie mehr.
Themen im Überblick:
1. Wie wird ein neues Medikament entwickelt?
Die Entwicklung eines neuen Medikaments ist ein komplexer und langwieriger Prozess, der oft mehr als zehn Jahre dauert und bis zu 2 Milliarden Euro kosten kann. Am Anfang steht die Entdeckung einer Substanz, die potenziell eine Krankheit heilen oder Symptome lindern kann. Diese Substanz kann eine chemische Verbindung, ein Pflanzen- oder Tierextrakt oder ein biotechnologisch hergestelltes Produkt sein. Aber bevor aus dieser Substanz ein sicheres und wirksames Medikament wird, muss sie viele Tests und Entwicklungsphasen durchlaufen. Die meisten Substanzen erreichen nie den Markt; nur eine aus Tausenden wird letztendlich als Medikament zugelassen.
Insgesamt teilt sich der Prozess der Medikamentenentwicklung in fünf Schritte:
1.1 Wirkstofffindung
1.2 Präklinische Entwicklung
1.3 Klinische Studien
1.4 Zulassung
1.5 Studien nach Marktzulassung
1.1 Was ist ein Wirkstoff? Welche Rolle spielt die Wirkstofffindung bei der Medikamentenentwicklung?
Ein Wirkstoff ist eine Substanz, die dazu bestimmt ist, eine bestimmte Wirkung im Körper zu erzielen, wie zum Beispiel eine Krankheit zu behandeln. Die Suche nach neuen Wirkstoffen ist ein wichtiger Schritt bei der Entwicklung neuer Medikamente. Forscher nutzen ihr Wissen über die Ursachen von Krankheiten und über die Funktion von Proteinen im Körper, um potenzielle Ziele für die Behandlung zu identifizieren. Proteine, die an Krankheiten beteiligt sind, können als Ziel (Target) für einen Wirkstoff dienen. Wissenschaftler aus verschiedenen Bereichen wie Medizin, Chemie, Biologie und Informatik arbeiten zusammen, um durch Tests in Zellkulturen und am Computer neue Substanzen zu finden und zu entwickeln. Diese Substanzen sollen an die Zielproteine binden und deren Funktion verändern, um die Krankheit zu behandeln.
1.2 Was ist eine präklinische Entwicklung?
Die präklinische Entwicklung ist ein Teil der Medikamentenentwicklung, bevor Tests mit Menschen gemacht werden. Zuerst wird ein Wirkstoff, der vielversprechend aussieht, gründlich getestet. Diese Tests fangen im Reagenzglas und mit Zellkulturen an. Wo es geht, versucht man, Tierversuche zu vermeiden und stattdessen mit Zellkulturen oder noch kleineren Teilen, sogenannten subzellulären Strukturen, zu arbeiten. Manche Dinge kann man aber nur im lebenden Organismus richtig testen. Daher werden Wirkstoffe, die die ersten Tests gut bestehen, auch in Tieren untersucht.
Experten für Pharmakokinetik (wie der Körper den Wirkstoff aufnimmt und verteilt) und Pharmakodynamik (wie der Wirkstoff im Körper wirkt) prüfen, wie der Wirkstoff den Tierkörper beeinflusst. Sie schauen sich an, wie gut der Wirkstoff wirkt, wie er im Körper verteilt wird und wie er wieder abgebaut oder ausgeschieden wird. Sie verwenden spezielle Testmethoden, um vorherzusagen, ob die Ergebnisse bei Tieren auch für Menschen gelten.
Bei Tests, die zeigen sollen, ob der Wirkstoff sicher ist, geht es darum, ob der Wirkstoff dem Herz oder den Nieren schadet, die Fortpflanzung oder die Entwicklung von Embryonen beeinträchtigt, Krebs verursacht oder das Erbgut verändert. Nur wenn ein Wirkstoff alle diese Tests besteht und sicher erscheint, darf er auch an Menschen getestet werden. Es wird auch entschieden, wie das Medikament verabreicht werden soll, zum Beispiel als Tablette zum Schlucken oder als Spritze. Zudem muss geprüft werden, ob man das Medikament auch in großen Mengen herstellen kann. Erst wenn das alles geklärt ist, beginnt die Phase der klinischen Forschung mit Menschen.
1.3 Was sind klinische Studien?
Bevor ein Medikament neu auf den Markt kommt oder für die Behandlung einer weiteren Krankheit zugelassen wird, müssen seine Wirksamkeit und Unbedenklichkeit in Studien, die auch als klinische Studien oder klinische Prüfungen bezeichnet werden, belegt werden.
Modifiziert nach
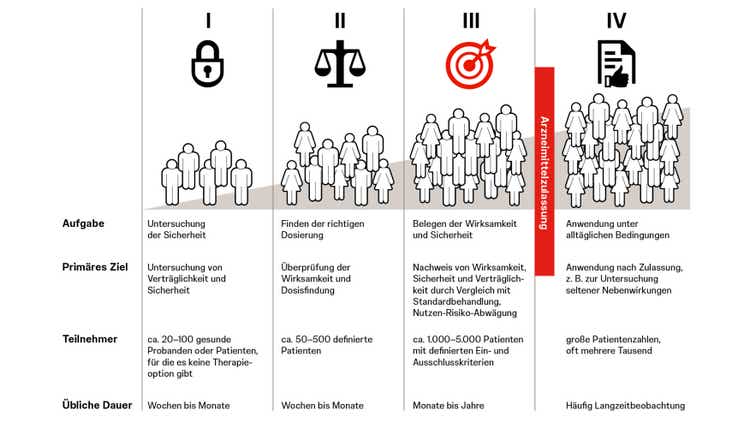
Phasen von klinischen Studien
Klinische Studien werden in Phasen I bis IV durchgeführt, wobei jede Phase spezifische Ziele hat:
- Phase I fokussiert sich auf die Untersuchung der Verträglichkeit, Sicherheit und Pharmakokinetik bei einer kleinen Gruppe von gesunden Freiwilligen (meist weniger als 100).
- In Phase II wird die Wirksamkeit und optimale Dosierung des Medikaments an einer spezifischen Patientengruppe von typischerweise 50 bis 500 Teilnehmern pro Studie getestet.
- Phase III zielt darauf ab, die Wirksamkeit und Verträglichkeit in einer größeren Patientenpopulation zu bestätigen, um die Grundlage für eine Marktzulassung zu schaffen. Hieran nehmen meist mehr als 1000 Patienten teil, manchmal auch mehrere tausend.
- Phase IV Studien, auch post-marketing Studien genannt, sammeln weitere Informationen über die Langzeiteffekte, Nebenwirkungen und die Effektivität des Medikaments in der breiten Bevölkerung.
1.4 Zulassung eines Arzneimittels
Im Zulassungsverfahren werden die vom Arzneimittelhersteller eingereichten Unterlagen zur pharmazeutischen Qualität, therapeutischen Wirkung und Unbedenklichkeit des Arzneimittels durch die zuständigen Behörden geprüft. Die Zulassung innerhalb mehrerer EU-Länder wird durch die Europäische Arzneimittelagentur (EMA) erteilt. Bei der Prüfung ist das deutsche Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) beteiligt bzw. – für Impfstoffe und biomedizinische Arzneimittel – das Paul-Ehrlich-Institut (PEI).
Nach der Zulassung eines Arzneimittels durch die zuständigen Behörden wird es für die Anwendung in der Praxis freigegeben. Die Forschung endet jedoch nicht mit der Zulassung. Nicht-interventionelle Studien (NIS) oder Anwendungsbeobachtungen (AWB) werden durchgeführt, um zu erforschen, wie sich das Medikament unter alltäglichen Bedingungen bewährt und um weitere Daten zur Sicherheit und Wirksamkeit zu sammeln.
Diese Informationen geben einen Überblick über den langen und komplexen Weg von der Idee bis zum fertigen Medikament. Jedes Stadium dieses Prozesses ist durch rigorose wissenschaftliche, rechtliche und ethische Standards geregelt, um die Sicherheit und Wirksamkeit der entwickelten Medikamente zu gewährleisten.
1.5 Studien nach Marktzulassung
Welche Behandlung bekommen Patient:innen bei der Anwendungsbeobachtung?
Wenn Patient:innen an einer Anwendungsbeobachtung (AWB) teilnehmen, ändert das nichts an ihrer Behandlung. Sie bekommen die Medikamente oder Therapien, die Ihre Ärztin oder Ihr Arzt ihnen sowieso verordnet hätte. Die persönlichen Daten von Patient:innen, die bei dieser Beobachtung gesammelt werden, dürfen nur mit deren Zustimmung verwendet werden. Diese Patient:innen helfen mit ihrer Teilnahme dabei, dass man mehr darüber lernt, wie die Therapie außerhalb der Anwendung im Rahmen einer klinischen Prüfung wirkt und wie sich die Krankheit entwickelt, weil ihre Daten für die Studie aufgeschrieben und analysiert werden dürfen.

Welchen Richtlinien unterliegt eine Anwendungsbeobachtung?
Anwendungsbeobachtungen müssen sich an strenge Regeln halten. Erstens müssen sie hohe Qualitätsstandards erfüllen. Dazu gehört, dass die Patient:innen gut informiert sind und ihrer Teilnahme zustimmen. Außerdem hat eine Ethikkommission die Studie geprüft. Diese Regeln stehen im Arzneimittelgesetz und im Kodex für die Pharma-Industrie, den auch die Firma Johnson & Johnson befolgt. Zweitens muss die Studie transparent sein: Das Vorhaben wird vor dem Start in einem öffentlichen Portal bei der zuständigen Behörde, wie dem BfArM oder dem PEI, eingetragen. Nachdem die Studie vorbei ist, veröffentlicht man dort eine Zusammenfassung der Ergebnisse – spätestens nach 12 Monaten.
Bekommen Ärzt:innen Geld für die Studie?
Ja, Ärzt:innen bekommen ein Honorar für ihre zusätzliche Arbeit, um Patientendaten in der Studie aufzuschreiben. Das Geld, das sie dafür bekommen, ist genau festgelegt und richtet sich nach den üblichen Gebühren für Ärzt:innen. Es ist so berechnet, dass Ärzt:innen nicht extra ein bestimmtes Medikament verschreiben oder empfehlen, nur weil sie an der Studie teilnehmen. Was Ärzt:innen verdienen, wird offengelegt; es wird den Ärzteverbänden und Krankenkassen mitgeteilt. Anwendungsbeobachtungen sind näher am Alltag als normale klinische Prüfungen und helfen zu sehen, wie gut neue Medikamente wirklich im täglichen Leben funktionieren.
Was habe ich bei der Teilnahme an einer klinischen Studie zu erwarten?
Wenn Sie an einer klinischen Studie teilnehmen, wird Ihre Ärztin oder Ihr Arzt mit Ihnen ein sehr ausführliches Informationsgespräch führen. Dabei geht es um ein Dokument, das Ihnen alles Wichtige zur Studie erklärt. Dieses Dokument nennt man "Patienteninformation und Einverständniserklärung". Es sorgt dafür, dass Sie alles über die Studie verstehen: was genau passiert, welche Nebenwirkungen oder Risiken es geben könnte und welche Rechte und Pflichten Sie als Teilnehmer haben. Sie erfahren auch, dass Sie die Studie jederzeit abbrechen können, wenn Sie das möchten, und werden über Dinge wie Versicherung und Datenschutz informiert. Wenn Sie nach dem Gespräch noch Fragen haben, können Sie diese mit Ihrer Ärztin oder Ihrem Arzt klären. Sie müssen sich nicht sofort entscheiden, ob Sie teilnehmen wollen. Wenn Sie zustimmen, an der Studie teilzunehmen, müssen Sie das schriftlich bestätigen.
Was ist, wenn ich es mir anders überlege?
Auch wenn Sie in die Teilnahme an der klinischen Studie eingewilligt haben, können Sie Ihre Meinung jederzeit ändern und Ihre Teilnahme an der klinischen Studie jederzeit beenden. Sie müssen keine Gründe für Ihre Entscheidung angeben.
Ist die Teilnahme für mich mit Kosten verbunden?
Nein. Sollten Sie für die Teilnahme an der klinischen Prüfung (Phase I-IV) infrage kommen, erhalten Sie das Prüfmedikament sowie die gesamte studienbezogene Betreuung kostenfrei. Im Rahmen von AWBs wird das Medikament im Rahmen der Routine verschrieben und über die Krankenkasse abgerechnet.
Checkliste
Sie interessieren sich für die Teilnahme an einer klinischen Studie? Unsere Checkliste hilft Ihnen, hilfreiche Fragen im Gespräch mit Ihrer beratenden Ärztin oder Ihrem beratenden Arzt zu stellen.
- Was ist das konkrete Ziel der klinischen Studie?
- Wie ist der Ablauf der Studie geplant?
- Wer finanziert die Studie?
- Entstehen Ihnen durch die Studienteilnahme Kosten?
- Gibt es eine Aufwandsentschädigung?
- Ist eine Probandenversicherung abgeschlossen worden?
- Mit welchem zeitlichen Aufwand ist die Teilnahme für mich als Studienteilnehmer:in verbunden?
- Welche Verpflichtungen sind mit der Studienteilnahme verbunden?
- Ist eine längere Nachbeobachtung nach Abschluss der Studie erforderlich?
- Welchen Nutzen und welche Risiken birgt die Studienteilnahme im Vergleich zu bisherigen Therapieverfahren?
- Welche Erfahrungen liegen für das neue Therapieverfahren bereits vor?
- Mit welchen Nebenwirkungen ist zu rechnen?
- Wer ist für die Studienbetreuung verantwortlich?
- Wer kann im Notfall oder bei auftretenden Fragen kontaktiert werden?
- Welche Daten werden erhoben, verarbeitet und gespeichert?
- Mit welchen Einschränkungen muss zu Beginn oder während der klinischen Studie gerechnet werden (z. B. keine Schwangerschaft, kein Alkohol)?
- Was passiert, wenn die Studie vorzeitig beendet wird?
- Falls erforderlich: wie kann die Behandlung nach dem Studienende weitergeführt werden?
2. In welchen Forschungs- bzw. Erkrankungsgebieten ist Johnson & Johnson aktiv?

Autoimmunerkrankungen

Psychische Erkrankungen

Seltene Erkrankungen
3. Patientensicherheit als oberste Priorität
Unser Credo bei Johnson & Johnson stellt die Verantwortung für unserer Patienten an die erste Stelle. Daher sind wir daran interessiert, möglichst viele Daten über die Sicherheit unserer Produkte zu erhalten. Ein wichtiger Baustein dieser Sicherheitsdaten sind Meldungen von Nebenwirkungen aus der Anwendung unserer Produkte in der Praxis. Was passiert aber mit diesen Meldungen, die bei uns eingehen? Warum ist es überhaupt sinnvoll, Nebenwirkungen zu melden? Und welche Rolle spielen Qualitätsmängel? Die Antworten auf diese Fragen finden Sie hier.
Nebenwirkungen
Wann spricht man von einer Nebenwirkung?
Nebenwirkungen sind unerwünschte Erkrankungen oder gesundheitliche Beschwerden, die auftreten, während Sie ein Medikament einnehmen oder nachdem Sie es eingenommen haben. Ihr Auftreten kann - muss aber nicht - mit der Einnahme des Medikaments zusammenhängen. Alle pharmazeutischen Unternehmen sind rechtlich dazu verpflichtet nachzuprüfen, ob die Einnahme ihrer Medikamente Nebenwirkungen verursacht.
Wie können sich Nebenwirkungen äußern?
Mögliche Nebenwirkungen können zum Beispiel Beschwerden wie Kopfschmerzen, Übelkeit oder Haarausfall sein, oder auch Erkrankungen wie Bluthochdruck oder Auffälligkeiten im Blutbild.
Wenn Sie ein Medikament einnehmen, ist es daher wichtig, dass Sie sich genau auf Nebenwirkungen achten, egal wie geringfügig diese auch sein mögen. Und es ist wichtig, dass Sie alle Änderungen Ihres Gesundheitszustandes Ihrer Ärztin, Ihrem Arzt oder dem/der Apotheker:in melden. Darüber hinaus haben Sie die Möglichkeit, eine Nebenwirkung auch direkt bei uns zu melden. Wie Sie dies machen, erfahren Sie unter dem Punkt „Meldung von Nebenwirkungen oder Produktqualitätsmängeln“.
Warum sollten Sie Nebenwirkungen melden?
Mit der Meldung von Nebenwirkungen helfen Sie den Gesundheitsbehörden (z. B. BfArM oder EMA) und pharmazeutischen Unternehmen wie Johnson & Johnson, dafür Sorge zu tragen, dass die betreffenden Medikamente sicher für den Gebrauch sind. Die Gesundheitsbehörden lassen neue Medikamente nur dann für den Gebrauch zu, wenn deren Wirksamkeit und Sicherheit in klinischen Prüfungen sowie die Qualität nachgewiesen wurden.

Damit wird sichergestellt, dass der Nutzen eines Medikaments die gesundheitlichen Risiken für Patient:innen überwiegt. Jedoch laufen klinische Prüfungen oft über einen kurzen Zeitraum und haben eine begrenzte Zahl von Patient:innen mit bestimmten Merkmalen (Alter, Gewicht, Geschlecht). Das bedeutet, dass die Medikamente möglicherweise nicht für alle Personenkreise geprüft werden, welche die betreffenden Medikamente später gegen ihre Krankheit einnehmen.
Ein zugelassenes Medikament wird möglicherweise von einem weit größeren Personenkreis und über längere Zeiträume eingenommen, als in den Studien untersucht wurde. Da jeder Mensch anders auf ein und dasselbe Medikament reagiert, werden nicht alle Nebenwirkungen in klinischen Prüfungen entdeckt. Eine einzelne Nebenwirkungsmeldung verschiebt zwar nicht unbedingt das Nutzen-Risiko-Verhältnis eines Medikaments, mehrfache Meldungen derselben Nebenwirkung bewirken dies aber schon.

Pharmazeutische Unternehmen wie Johnson & Johnson und die Gesundheitsbehörden überwachen engmaschig alle Informationen zur Sicherheit dieser Medikamente. Damit soll sichergestellt werden, dass der Nutzen der Medikamente auch weiterhin die Risiken überwiegt. Zudem werden Betroffene und medizinische Fachkreise über alle neu entdeckten Risiken informiert. Es ist deshalb wichtig, dass Sie Ihre Ärztin, Ihren Arzt oder den/die Apotheker:in informieren, falls Sie bei der Einnahme eines Medikaments eine Nebenwirkung haben. Ihre Unterstützung ermöglicht es uns, Ihre und die Gesundheit anderer Betroffenen zu schützen. Außerdem helfen Sie uns damit, korrekte und aktuelle Angaben zur Sicherheit der Produkte zur Verfügung zu stellen.
Qualitätsmängel
Was versteht man unter Qualitätsmängeln?
Bei Qualitätsmängeln handelt es sich um Qualitätsminderungen, die am Produkt selbst auftreten können.
Fehlerhafte Verpackung, Beschriftung oder Befüllung sowie fehlende oder beschädigte Bestandteile (z. B. zerbrochenes Fläschchen, beschädigter Deckel, unleserliche Angaben, zu viel oder zu wenig Inhalt oder Verdacht auf Manipulation etc.)
Physikalische Veränderungen am Produkt wie Verfärbungen, Volumenänderungen, Eintrübungen (z. B. Schwemmstoffe oder Bodensatz in Flüssigkeiten, die eigentlich klar sein sollten)
Fehlfunktion eines medizinischen Geräts, das heißt, das Gerät funktioniert nicht wie vorgesehen (und in der Kennzeichnung/Spezifikation des Geräts angegeben). Das kann zum Beispiel eine Insulinpumpe sein, die zur falschen Zeit Insulin injiziert, oder eine Fertigspritze, die undicht ist und deshalb eine zu geringe Medikamentendosis enthält.
Warum sollten Sie Qualitätsmängel melden?
Durch die Meldung von Qualitätsmängeln erhalten wir bei Johnson and Johnson wertvolles Feedback zu unseren Produkten (Medikamente und Verabreichungssysteme), das zum Schutz von Verbraucher:in und Patient:innen beitragen kann. Indem Sie einen Qualitätsmangel melden, unterstützen Sie uns dabei, rasch etwaige Unzulänglichkeiten in Bauweise, Herstellung, Transport oder anderen Bereichen festzustellen, die die Qualität eines Produkts beeinträchtigen können, so dass wir die erforderlichen Korrekturmaßnahmen ergreifen können. Bei diesen Korrekturmaßnahmen kann es sich zum Beispiel um Änderungen im Herstellungsprozess handeln, oder die Neugestaltung der Verpackung. In manchen Fällen kann es auch eine Rückrufaktion sein, mit der Teile oder das gesamte Produkt vom Markt genommen werden.
Bitte geben Sie mindestens die Bezeichnung des Medikaments oder Produktes an und eine Beschreibung der Nebenwirkung bzw. des Qualitätsmangels. Um uns eine rasche und effektive Bearbeitung von Nebenwirkungsmeldungen oder eines Qualitätsmangels zu ermöglichen, machen Sie bitte die folgenden Angaben (falls bekannt):
- Angaben zur meldenden Person: Ihr Name und Ihre Kontaktdaten (anonyme Meldungen sind selbstverständlich ebenfalls möglich).
- Angaben zur betroffenen Person: Angaben zu Verbraucher:in oder Patient:in wie Alter oder Altersgruppe (z. B. Kind, Erwachsener), Geschlecht, mögliche (Vor-)Erkrankungen oder chronische Erkrankungen des/der Verbraucher:in oder Patient:in (Qualitätsmängel können auch ohne Beteiligung von Verbraucher:innen oder Betroffenen auftreten).
- Produktname: Handelsname oder Wirkstoffname des Medikaments oder Produkts von Johnson and Johnson.
- Beschreibung der Nebenwirkung oder des Qualitätsmangels: Bitte beschreiben Sie die Nebenwirkung oder den Qualitätsmangel so detailliert wie möglich (z. B. mit Angabe der Chargen-Nummer, falls bekannt). Bitte geben Sie alle wichtigen Termine oder Zeiträume an (z. B. wie viel Zeit zwischen Beginn der Medikamenteneinnahme und dem Auftreten der Nebenwirkung verstrichen ist bzw. eine Beschreibung des Produktqualitätsmangels).
Was geschieht mit Ihrer Meldung?
Wir werden Ihre Meldung prüfen und uns möglicherweise mit Ihnen in Verbindung setzen, um Details zu klären oder weitere Einzelheiten zu erfragen. Im Unternehmen werden alle Meldungen (Nebenwirkungen oder Qualitätsmängel) analysiert und dann in eine weltweite, vom Unternehmen geführte Datenbank eingegeben. Dort werden die Meldungen gesammelt.
Ihre Angaben sind eine große Hilfe, nicht nur für uns, sondern für alle Betroffenen, die unsere Medikamente benutzen. Die Informationen zur Produktsicherheit werden geprüft und von einschlägigen Expert:innen wissenschaftlich ausgewertet. Die Daten werden regelmäßig analysiert, um festzustellen, ob es bei einem Medikament neue Nebenwirkungen oder bei einem Produkt neue Qualitätsmängel gibt und wie man die bereits bekannten Nebenwirkungen oder Qualitätsmängel besser einordnen bzw. ihre Zahlen besser berechnen kann.
Wann immer neue Risiken festgestellt werden, informieren wir die medizinischen Fachkreise und ergreifen alle Maßnahmen, die erforderlich sind, um die Sicherheit der Patient:innen, die unsere Medikamente nutzen, zu gewährleisten.
Die Sicherheit der Patient:innen und die Qualität unserer Arzneimittel stehen für uns an erster Stelle. Wir sind Mitglied des Aktionsbündnis Patientensicherheit. Die Initiative setzt sich für eine sichere Gesundheitsversorgung ein und widmet sich der Erforschung, Entwicklung und Verbreitung dazu geeigneter Methoden.
Wie melden Sie eine Nebenwirkung oder einen Qualitätsmangel?
Wenn Sie uns eine Nebenwirkung oder einen Qualitätsmangel melden möchten, nutzen Sie dazu bitte die folgenden Kontaktmöglichkeiten:
Telefon: +49 2137 955291
E-Mail:PVGer@its.jnj.com
4. Häufig gestellte Fragen zu klinischen Studien
Was ist eine klinische Studie?
Eine klinische Studie ist eine Forschungsstudie, in der neue Medikamente oder Behandlungen an Menschen getestet werden, um ihre Sicherheit und Wirksamkeit zu überprüfen.
Warum sollte ich an einer klinischen Studie teilnehmen?
Teilnehmer an klinischen Studien können Zugang zu neuen Therapien erhalten, bevor diese allgemein verfügbar sind, und sie tragen dazu bei, die medizinische Forschung voranzutreiben.
Ist die Teilnahme an einer klinischen Studie sicher?
Klinische Studien folgen strengen Regeln zum Schutz der Teilnehmer. Risiken bestehen, aber Sie werden über alle bekannten Risiken aufgeklärt, bevor Sie zustimmen.
Was passiert, wenn ich mich für eine Studie anmelde?
Sie erhalten eine detaillierte Aufklärung über die Studie, mögliche Risiken und Ihre Rechte. Bei Einwilligung werden Sie entsprechend den Studienanforderungen behandelt und überwacht.
Kann ich die Studie jederzeit verlassen?
Ja, Sie können Ihre Teilnahme an einer klinischen Studie jederzeit ohne Nachteile beenden.
Werden meine persönlichen Daten in der Studie geschützt?
Ihre Daten werden vertraulich behandelt und nur mit Ihrer Zustimmung gesammelt und verwendet.
Erhalte ich eine Entschädigung für meine Teilnahme?
Dies kann je nach Studie variieren. In manchen Fällen gibt es eine Aufwandsentschädigung für die Teilnehmer.
Wie lange dauert eine klinische Studie?
Die Dauer einer klinischen Studie kann unterschiedlich sein und hängt vom Studienprotokoll ab.
Was sind die möglichen Vorteile einer Studienteilnahme?
Mögliche Vorteile können der Zugang zu neuen Therapien und eine intensivere medizinische Überwachung sein.
Welche Art von Nachsorge wird nach der Studienteilnahme angeboten?
Die Nachsorge richtet sich nach der Art der Studie. In der Regel werden Sie weiterhin von Ihrem Studienteam oder Arzt betreut.
Dieser Text entspricht den redaktionellen Standards der J&J withMe und wurde von einem Mitglied des redaktionellen Beirats der J&J withMe geprüft. Lernen Sie hier den medizinischen Beirat unserer Redaktion kennen.
EM-150081